a英国伦敦帝国理工学院外科与癌症系帝国前列腺外科 b帝国泌尿外科,查令十字医院,帝国理工学院医疗保健NHS信托基金,英国伦敦 c荷兰乌得勒支大学医学中心放射肿瘤学系 d圣安娜泌尿科,瑞士卢塞恩 e梅奥医疗国际泌尿外科,美国明尼苏达州罗切斯特 f瑞士洛桑洛桑大学医院泌尿科 g英国阿默舍姆白金汉郡医院NHS信托泌尿科 h伦敦大学学院外科与介入科学系,英国伦敦 i英国伦敦大学学院医院 j英国南安普敦南安普敦大学医院 NHS 信托基金泌尿科 k贝辛斯托克泌尿科和北汉普郡医院,汉普郡医院NHS基金会信托基金,英国贝辛斯托克 l BMI 汉普郡诊所,英国贝辛斯托克 m英国皇家萨里NHS基金会信托基金泌尿科 n BMI安微尼亚山医院,英国吉尔福德 o多塞特郡医院基金会信托基金,英国多切斯特 p英国切姆斯福德斯普林菲尔德医院 q英国伦敦皇家马斯登医院NHS基金会信托基金学术泌尿科 r英国雷克瑟姆雷克瑟姆梅勒医院泌尿科 s北布里斯托尔NHS信托,英国布里斯托尔特里姆韦斯特伯里 t亚历山德拉公主医院 NHS 信托基金泌尿科,英国哈洛 u英国伦敦格蕾丝王妃医院 v英国伦敦爱德华七世国王医院 w英国伦敦克伦威尔医院 x埃及开罗艾因夏姆斯大学医院泌尿科 导 言 这项2022年发表在《欧洲泌尿外科》上的研究,报告了局灶性Sonablate高强度聚焦超声(HIFU)治疗非转移性前列腺癌后的肿瘤学结局和不良事件。这些数据前瞻性地记录在HIFU治疗评价与评估(HEAT)登记研究处,囊括了针对1379名前列腺癌患者的6个月以上随访数据。值得注意的是,这项研究包括来自英国13个中心的数据,其中24%的患者接受了五年以上的随访,还有部分患者的随访时间长达15年。本项目的研究数据显示了局灶性Sonablate HIFU的长期治疗结局,很多患者在HIFU治疗中长期获益。 △ 关键字
局灶治疗,高强度聚焦超声,肿瘤学结局,前列腺癌
△ 前导
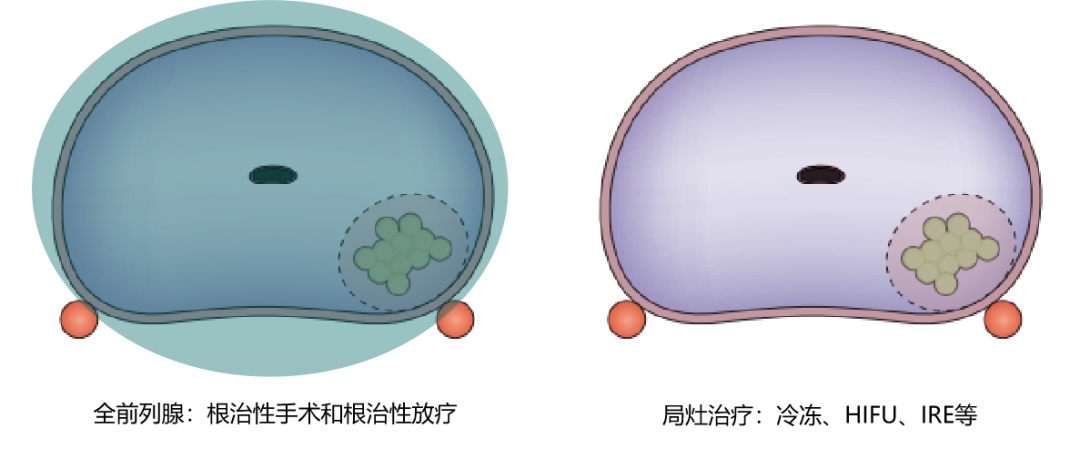
局灶治疗旨在治疗癌症区域以控制肿瘤,同时减少与治疗相关的功能损害。
针对非转移性、临床上显著的前列腺癌患者的治疗包括使用根治性前列腺切除术或根治性全腺体放疗方法[1],[2],[3]。对于中危和高危前列腺癌患者,根治性治疗可改善无进展生存率和癌症特异性生存率,但是可能引起一些治疗相关并发症,包括对泌尿生殖系统和直肠的副作用[4],[5]。
随着对临床上显著前列腺癌的诊断准确性及定位精准度提高,医生可以考虑为谨慎筛选的患者提供局灶治疗[6]。局灶治疗虽然最初被视为主动监测的替代方法,但时至今日,针对确诊中高危局灶前列腺癌的患者,局灶治疗可被视为一种可能替代根治性治疗的潜在治疗方式[7],[8],[9],[10],同时最大限度地减少治疗相关的并发症和副作用[11],[12],[13]。
△ 目标
报告局灶性高强度聚焦超声(HIFU)治疗非转移性前列腺癌后的肿瘤学结局和不良事件。
△ 研究设计、设备和参与者
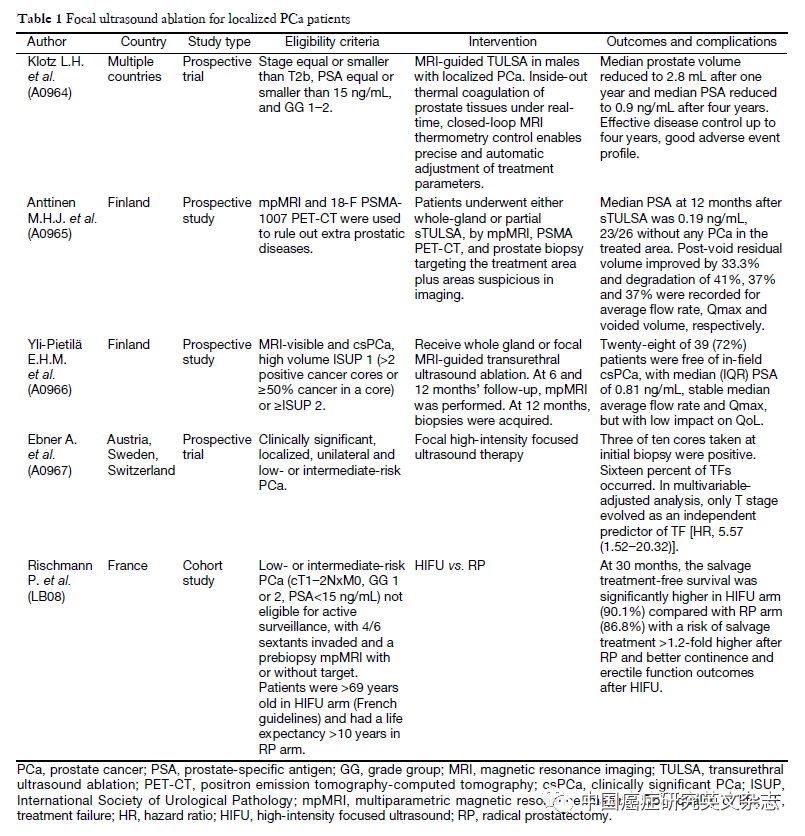
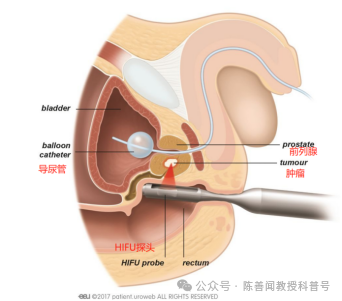
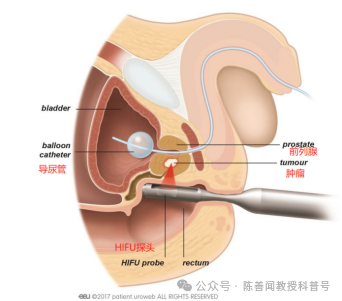
对来自英国13个研究中心(2005-2020年)的HIFU治疗评价与评估(HEAT)登记处前瞻性记录的1379名随访时间≥6个月的患者进行了分析,其中325例(24%)患者可进行五年或更长时间的随访。局灶性HIFU治疗使用经直肠超声引导装置(Sonablate设备,设备制造商Sonacare Inc.,美国北卡罗来纳州夏洛特)。
在2005年11月至2020年7月期间,研究团队在英国13个研究中心使用了 Sonablate(500和3G)设备。在局灶性 HIFU治疗后,在HEAT登记研究处报告了共1379名随访时间≥6个月的前列腺癌患者,Gleason评分为6-9分的前列腺癌和TNM分期高达T3bN0M0的患者接受了局灶治疗。这项研究免于伦理委员会的批准,并且要求患者知情同意。
△ 结局测量和统计分析
无失败生存率(FFS)主要定义为无需挽救性局灶或全腺体治疗、也未出现癌症转移的生存率。D'Amico风险组之间的FFS差异是通过对数秩分析确定的。使用Clavien-Dindo分类报告不良事件。
△ 主要结局
总体中位随访时间(IQR)为32(17-58)个月,325例随访时间为82(72-94)个月,随访时间≥5年。无报告事件患者(n = 1218)的中位随访时间(IQR)为19(5-43)个月,出现失败事件的中位时间(IQR)为42(27-63)个月。中位年龄(IQR)为66(60-71)岁,PSA为6.9(4.9-9.4)ng/ml(表1)。大多数患者(65%,896/1379)为中危前列腺癌,经会阴活检后诊断(见表1)。

表1 – 非转移性前列腺癌局灶性HIFU患者的基线特征
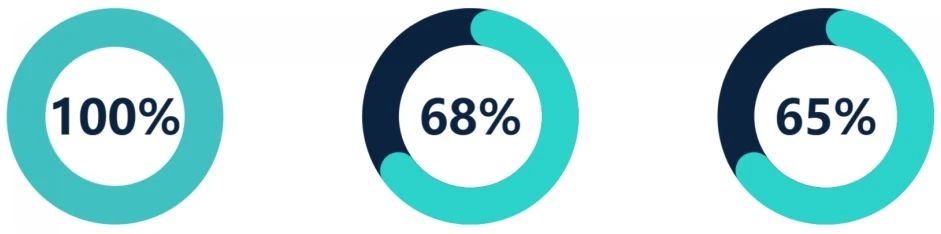
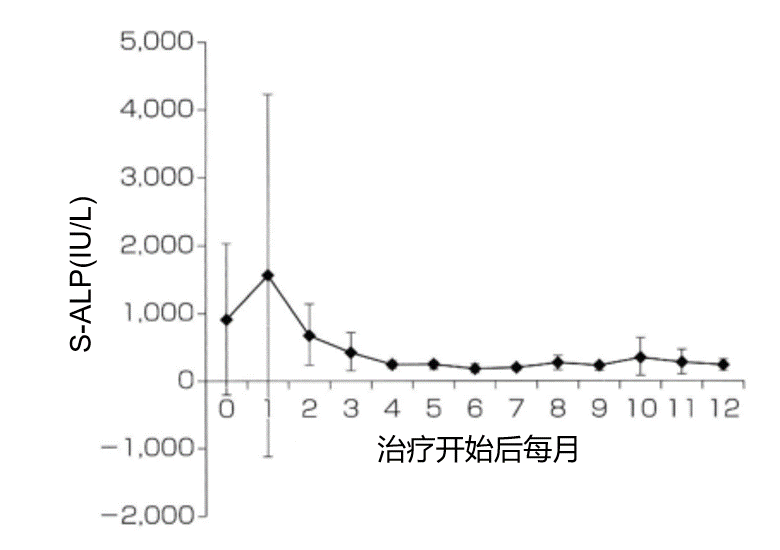
前列腺特异性抗原为6.9(4.9-9.4)ng/ml,D'Amico中度风险为65%(896/1379),高风险为28%(386/1379)。总体中位随访时间为32(17-58)个月;对于随访时间为≥5年的患者,为82(72-94)个月。共有252例患者因残留或复发性癌症而重复局灶治疗;共有92名患者需要挽救性全腺体治疗。Kaplan-Meier 7年FFS为69%(64-74%)。中高危前列腺癌的7年FFS为68%(95%置信区间[CI] 62-75%)和65%(95%置信区间56-74%; p = 0.3)。Clavien-Dindo >2不良事件发生率为0.5%(7/1379)。


据我们所知,这是任何形式下、迄今为止针对局灶消融技术的最大研究队列报告。我们在英国的多中心研究表明,在非转移性前列腺癌的原发性局灶性HIFU治疗后7年,FFS率为69%。7年无前列腺癌特异性死亡和无转移生存率为100%,7年总生存率为97%,与近期发表的系列研究相似[14]。

无失败生存(FFS)的Kaplan-Meier曲线及95% 置信区间。FFS定义为过渡到全腺挽救治疗或第三次局灶治疗,系统治疗和/或前列腺癌转移和/或前列腺癌特异性死亡的发展,(A)所有随访至少6个月的患者和(B)1365名患者按D'Amico低风险(绿线),中风险(蓝线)和高风险(红线)组分层(D'Amico中危与高风险疾病的对数排名分析,p = 0.3)。
△ 患者总结和结论
在谨慎挑选的具有临床意义的前列腺癌症患者中,每10名患者中有6名和3名分别患有中危和高危前列腺癌,他们在接受局灶性HIFU治疗后获得了良好的中期肿瘤学控制。
对患有癌症的前列腺区域进行局灶性HIFU治疗可作为替代全腺体治疗的治疗方案。这种治疗方式在7年内具有良好的中期肿瘤学控制。
△ 参考文献
[1] Hamdy FC, Donovan JL, Lane JA, et al. 10-Year outcomes after monitoring, surgery, or radiotherapy for localized prostate cancer. N Engl J Med 2016;375:1415–24.
[2] Wilt TJ, Jones KM, Barry MJ, et al. Follow-up of prostatectomy versus observation for early prostate cancer. N Engl J Med 2017;377:132–42.
[3] Okamoto K, Okuyama K, Kohno N, Tsugawa T. Clinical outcomes of low-dose-rate brachytherapy based radiotherapy for intermediate risk prostate cancer. J Contemp Brachyther 2020;12:6–11.
[4] Resnick MJ, Koyama T, Fan KH, et al. Long-term functional outcomes after treatment for localized prostate cancer. N Engl J Med 2013;368:436–45.
[5] Zhang P, Qian B, Shi J, Xiao Y. Radical prostatectomy versus brachytherapy for clinically localized prostate cancer on oncological and functional outcomes: a meta-analysis. Transl Androl Urol 2020;9:332–43.
[6] Lomas DJ, Ahmed HU. All change in the prostate cancer diagnostic pathway. Nat Rev Clin Oncol 2020;17:372–81.
[7] Tay KJ, Scheltema MJ, Ahmed HU, et al. Patient selection for prostate focal therapy in the era of active surveillance: an International Delphi Consensus Project. Prostate Cancer Prostatic Dis 2017;20:294–9.
[8] Muller BG, van den Bos W, Pinto PA, de la Rosette JJ. Imaging modalities in focal therapy: patient selection, treatment guidance, and follow-up. Curr Opin Urol 2014;24:218–24.
[9] Ouzzane A, Betrouni N, Valerio M, RAStinehad A, Colin P, Ploussard Q. Focal therapy as primary treatment for localized prostate cancer: definition, needs and future. Future Oncol 2017;12:727–41.
[10] Donaldson IA, Alonzi R, Barratt D, et al. Focal therapy: patients, interventions, and outcomes–a report from a consensus meeting. Eur Urol 2015;67:771–7.
[11] Shah TT, Peters M, Eldred-Evans D, et al. Early-medium-term outcomes of primary focal cryotherapy to treat nonmetastatic clinically significant prostate cancer from a prospective multicentre registry. Eur Urol 2019;76:98–105.
[12] Kasivisvanathan V, Emberton M, Ahmed HU. Focal therapy for prostate cancer: rationale and treatment opportunities. Clin Oncol (R Coll Radiol) 2013;25:461–73.
[13] Ahmed HU, Pendse D, Illing R, Allen C, van der Meulen JH, Emberton M. Will focal therapy become a standard of care for men with localized prostate cancer? Nat Clin Pract Oncol 2007;4:632–42.
[14] Tourinho-Barbosa RR, Sanchez-Salas R, Claros OR, et al. Focal therapy for localized prostate cancer with either high intensity focused ultRASound or cryoablation: a single institution experience. J Urol 2020;203:320–30.